Quy trình cấp chứng nhận J-GMP diễn ra như thế nào?
Toc
Cùng với EU-GMP, PICs-GMP thì J-GMP là một trong những tiêu chuẩn nước ngoài về thực hành tốt sản xuất dược phẩm phổ biến tại Việt Nam. J-GMP là một trong những tiêu chuẩn khắt khe về sản xuất trong ngành dược. Trên lý thuyết, tiêu chuẩn này được đánh giá là tương đương tiêu chuẩn EU-GMP.
Vậy doanh nghiệp cần lưu ý điều gì khi cần xin chứng nhận J-GMP? GMP EU sẽ tổng hợp những kiến thức quan trọng trong quy trình chứng nhận J-GMP trong bài viết này.

Mục Lục Bài Viết
1. Một vài nét chung về J-GMP
1.1. J-GMP là gì?
J-GMP (Japan GMP) là một tiêu chuẩn về thực hành sản xuất tốt dược phẩm được Nhật Bản thiết lập vào năm 1974 và có hiệu lực năm 1975. Như vậy, J-GMP ra đời trước EU-GMP (Tiêu chuẩn thực hành tốt sản xuất dược phẩm Châu Âu ban hành năm 1989), và ngày càng được cập nhật, cải thiện. J-GMP được cơ quan dược phẩm và thiết bị Y tế Nhật Bản (PMDA) quản lý và trực tiếp cấp giấy chứng nhận cho những cơ sở đạt yêu cầu.
Xem thêm: Quy trình chứng nhận EU-GMP
Tiêu chuẩn này lập nên những khung tiêu chuẩn về nguyên liệu, cách bảo quản sản phẩm vô trùng, quản lý hệ thống chất lượng… Từ đó, đảm bảo chất lượng thuốc đến tay người tiêu dùng.
1.2. Lợi ích khi đạt tiêu chuẩn J-GMP
- Đối với doanh nghiệp:
Sở hữu dây chuyền sản xuất đạt chuẩn J-GMP là tấm vé để doanh nghiệp đưa sản phẩm của mình đến với các thị trường khác đặc biệt là thị trường khó tính như Nhật Bản và một số nước ASEAN
J-GMP được đánh giá là một tiêu chuẩn khắt khe và cơ chế kiểm soát đáng tin cậy. Do đó, doanh nghiệp sở hữu chứng nhận này sẽ có được uy tín với đối tác, khách hàng. Từ đó mở ra rất nhiều cơ hội phát triển cho doanh nghiệp.
Trong thị trường Việt Nam, J-GMP giúp tăng khả năng cạnh tranh với các doanh nghiệp khác đặc biệt là các doanh nghiệp nước ngoài.
- Đối với người tiêu dùng
Khi sử dụng sản phẩm đến từ cơ sở sản xuất đạt J-GMP đồng nghĩa với việc người tiêu dùng trong nước có thể tiếp cận với các sản phẩm đạt tiêu chuẩn hàng đầu quốc tế ngay tại nước nhà với mức chi phí phù hợp.
2. Chi tiết quy trình chứng nhân J-GMP
Doanh nghiệp được nhận J-GMP cần phải trải qua nhiều bước đánh giá. Quá trình này thường kéo dài 16-27 tháng với hai giai đoạn.
2.1. Giai đoạn 1
Doanh nghiệp hoặc cơ sở thuốc đăng ký cần được cấp giấy phép hoạt động trong lĩnh vực dược phẩm tại Nhật Bản.
2.2. Giai đoạn 2
Cơ quan có thẩm quyền tại Nhật Bản sẽ đánh giá và công nhận đạt tiêu chuẩn J-GMP cho sản phẩm được doanh nghiệp đăng ký.
Trong giai đoạn 2, trước tiên, cơ quan PMDA tiến hành đánh giá các sản phẩm đã được các doanh nghiệp đăng ký. Sản phẩm được kiểm tra và đánh giá về chất lượng, tính hiệu quả và độ an toàn một cách khắt khe và kỹ lưỡng.
Và sau đó, nếu các sản phẩm đạt tiêu chuẩn thì PMDA sẽ đánh giá cơ sở hạ tầng, điều kiện sản xuất, máy móc thiết bị, nhân viên,…theo tiêu chuẩn J-GMP.
Có hai loại hình thanh tra GMP mà PMDA thực hiện
- Trường hợp cơ sở nộp đơn đăng ký cấp giấy phép hoạt động trong lĩnh vực dược phẩm
- Các cuộc thanh tra 5 năm một lần sau khi cấp chứng nhận
3. Phương thức nộp các tài liệu cần thiết cho PMDA để áp dụng kiểm tra
3.1. Checklist kiểm tra
Người đại diện doanh nghiệp cần chuẩn bị đầy đủ thông tin theo checklist kiểm tra 1 hoặc checklist kiểm tra 2. Tất cả đều được đính kèm với biểu mẫu kiểm tra và các tài liệu cần thiết cho việc kiểm tra.
Checklist 1 là cho trường hợp cơ sở nộp đơn kiểm tra đánh giá GMP lần đầu hoặc thay đổi dữ liệu đã phê duyệt


3.2. Thời hạn xét duyệt tiêu chuẩn J-GMP
Thông thường thời gian từ khi đăng kí đến khi đạt được chứng nhận J-GMP sẽ mất khoảng một năm. Để nộp được hồ sơ đăng kí thì doanh nghiệp phải trải qua sự kiểm tra về tính an toàn, hiệu quả, chất lượng,… của sản phẩm. Doanh nghiệp nộp đơn đăng kí cần chuẩn bị đầy đủ các tài liệu cần thiết về các khâu thẩm định, kiểm tra,…
3.3. Hiệu lực giấy chứng nhận J-GMP
Thời hạn hiệu lực của giấy chứng nhận có giá trị 5 năm kể từ ngày cấp. Như đã đề cập, sau thời hạn trên, các doanh nghiệp cần được tiến hành đánh giá lại qua các vòng của PMDA để được gia hạn giấy chứng nhận J-GMP.
Khi hệ thống tiêu chuẩn cập nhật những nội dung mới thì các doanh nghiệp cũng cần cập nhật và đáp ứng theo.
Sau khi được cấp giấy chứng nhận, doanh nghiệp có trách nhiệm phải duy trì chất lượng hệ thống sản xuất và báo cáo lại các thay đổi nếu có.
4. Quy trình kiểm tra tiêu chuẩn J-GMP đối với các doanh nghiệp nước ngoài
Đơn xin kiểm tra tuân thủ của các cơ sở sản xuất nước ngoài có thể được đăng ký bởi người giữ giấy tiếp thị, người nộp đơn xin giấy phép tiếp thị, người được nhà sản xuất ủy quyền.
Về nguyên tắc, kiểm tra Tuân thủ GMP sẽ được PMDA tiến hành kiểm tra tại chỗ. Tuy nhiên, PMDA có thể tiến hành kiểm tra trên các tài liệu (kiểm tra tại bàn).
PMDA cũng có trách nhiệm báo cáo kết quả đánh giá, kiểm tra lên Bộ y tế. PMDA sẽ cấp một bản sao thông báo kết quả thẩm tra tuân thủ GMP cho người giữ giấy phép tiếp thị đã đăng kí kiểm tra và một bản sao gửi cho nhà sản xuất nước ngoài kiểm tra tại chỗ. Với phương thức kiểm tra tại bàn, bản sao báo cáo kiểm tra sẽ không được cấp.
Sau đây là sơ đồ minh họa quy trình kiểm tra tuân thủ GMP:
Lưu ý rằng quy trình khác nhau phụ thuộc vào việc các hồ sơ tài liệu gốc có được sử dụng hay không.
- Quy trình kiểm tra tại chỗ không sử dụng hồ sơ gốc:
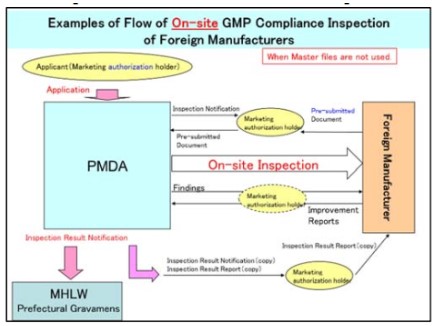
- Quy trình kiểm tra tại chỗ sử dụng hồ sơ gốc:
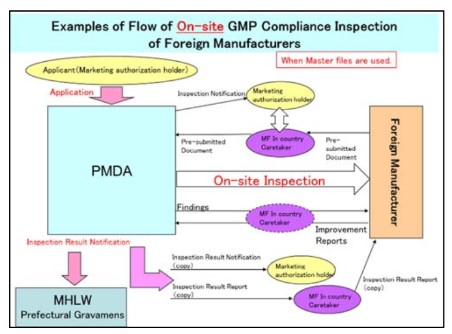
- Quy trình kiểm tra tại bàn không sử dụng hồ sơ gốc:
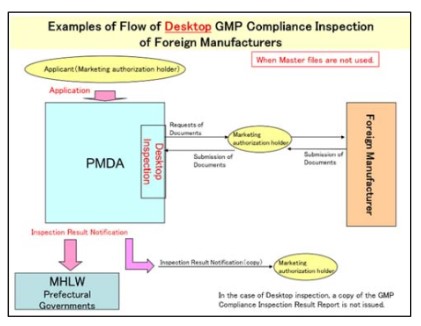
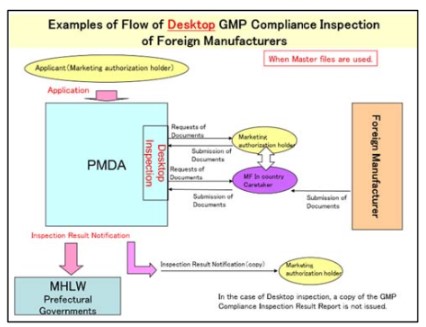
- Quy trình kiểm tra tuân thủ GMP tại bàn sử dụng hồ sơ gốc:
5. Quy trình công bố đạt J-GMP tại Việt Nam
Sau khi có chứng nhận J-GMP, doanh nghiệp cần đề nghị với Cục quản lý Dược Việt Nam công bố cơ sở sản xuất đạt J-GMP. Theo thông tư 15/2019/TT-BYT ngày 11/7/2019, công bố này sẽ là cơ sở để doanh nghiệp tham gia thầu thuốc kênh bệnh viện nhóm thuốc generic. Do vậy, việc đề nghị công bố cũng là công điều không thể chậm trễ.
GMP EU – INTECH Group là đơn vị chuyên cung cấp giải pháp tổng thể về tư vấn thiết kế nhà máy, phòng sạch trong lĩnh vực dược phẩm, thực phẩm, y tế,… tại Việt Nam. Năm 2024, bằng việc kí kết với đối tác Pharmzone GMMP EU – INTECH Group luôn tự tin sẵn sàng với giải pháp nhanh chóng tối ưu trong quy trình xin cấp giấy chuẩn J-GMPVới hơn 5năm kinh nghiệm trong việc tư vấn hồ sơ thẩm định GMP hân hạnh đồng hành cùng quý doanh nghiệp để cùng tạo ra những sản phẩm chất lượng nhất !












