PHÂN LOẠI MỨC ĐỘ VI PHẠM TIÊU CHUẨN GMP
Toc
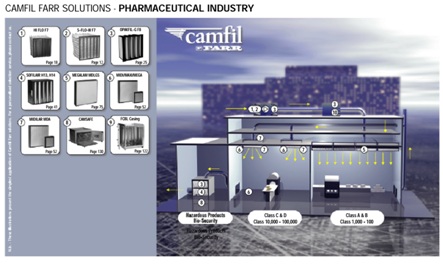
Trong quá trình xây dựng và vận hành nhà máy sản xuất dược phẩm, các công ty, doanh nghiệp gặp rất nhiều khó khăn trong việc đáp ứng và duy trì các nguyên tắc, tiêu chuẩn theo quy định. Các vi phạm có thể xuất hiện trong bất cứ công đoạn nào của quá trình sản xuất. Vậy phân loại mức độ vi phạm và mức độ đáp ứng thực hành tốt sản xuất thuốc, nguyên liệu làm thuốc của các cơ sở sản xuất như thế nào? Hãy cùng chúng tôi tìm hiểu.
Mục Lục Bài Viết
Phân loại mức độ vi phạm
Theo phụ lục IX của Thông tư số 35/2018/TT-BYT do Bộ Y tế ban hành, các vi phạm của cơ sở sản xuất dược phẩm sẽ được phân thành 3 mức độ khác nhau.
1.1 Tồn tại nghiêm trọng
Các vi phạm được coi là tồn tại nghiêm trọng khi sai sót đó có nguy cơ gây ra ảnh hưởng nghiêm trọng đến việc sản xuất có thể tạo ra những sản phẩm gây hại đến sức khoẻ, tính mạng của người sử dụng. Bao gồm cả những sai phạm về gian lận, giả mạo, sửa chữa số liệu hoặc dữ liệu của cơ sở sản xuất.
Ví dụ về vi phạm nghiêm trọng tiêu chuẩn GMP là sai sót dẫn đến thuốc không đáp ứng các quy định hoặc tạo ra nguy cơ ở hiện tại hoặc trong tương lai sẽ ảnh hưởng đến sức khoẻ của người sử dụng.
1. https://phongsachtst.com/xay-dung-va-tham-dinh-phong-sach-trong-san-xuat-duoc/
2. https://phongsachtst.com/so-sanh-phan-biet-giua-ahu-va-fcu/

1.2 Tồn tại nặng
Trong nhà máy sản xuất đạt tiêu chuẩn GMP, tồn tại nặng là những vi phạm, sai sót:
– Có thể dẫn đến sản xuất ra các sản phẩm không tuân thủ theo giấy phép lưu hành sản phẩm.
– Liên quan đến một tồn tại nặng đã được quy định trong GMP hoặc sự sai lệch lớn không đúng với các quy định về điều kiện sản xuất.
– Không tuân thủ quy trình xuất xưởng lô hoặc người có thẩm quyền, người phụ trách không đáp ứng được yêu cầu về trình độ chuyên môn, kinh nghiệm để đảm nhiệm công việc được giao.
– Gồm nhiều vi phạm mà khi xuất hiện cùng nhau sẽ tạo thành một tồn tại nặng và được phân tích, báo cáo như một tồn tại nặng.
1.3 Tồn tại nhẹ
Vi phạm nhẹ tiêu chuẩn GMP là một sai lệch so với các nguyên tắc, tiêu chuẩn đã được quy định, nhưng không được xếp vào tồn tại nặng hoặc tồn tại nghiêm trọng.
Phân loại mức độ đáp ứng GMP của cơ sở sản xuất
Mức độ đáp ứng GMP của nhà máy sản xuất dược phẩm được phân loại theo số tồn tại mà cơ sở gặp phải:
2. https://phongsachtst.com/nguyen-tac-kiem-soat-tinh-dien-tren-nguoi-va-thiet-bi/
3. https://phongsachtst.com/nha-may-san-xuat-my-pham-dat-chuan-gmp-co-nhung-gi/
4. https://phongsachtst.com/cac-loai-phong-sach-theo-iso-va-ung-dung/
5. https://phongsachtst.com/khu-vuc-epa-la-gi-cach-thiet-lap-khu-vuc-epa-dat-chuan/
– Mức độ 1: Đơn vị không mắc bất kỳ tồn tại nghiêm trọng hoặc tồn tại nặng nào.
– Mức độ 2: Đơn vị không có tồn tại nghiêm trọng và có từ 1 – 6 tồn tại nặng.
– Mức độ 3: Đơn vị không có tồn tại nghiêm trọng và có từ 7 – 14 tồn tại nặng.
– Mức độ 4: Đơn vị có mắc tồn tại nghiệm trọng và/ hoặc có từ 15 tồn tại nặng trở lên.

Trong quá trình vận hành nhà máy sản xuất dược phẩm không thể tránh khỏi những tồn tại, vi phạm tiêu chuẩn GMP có thể xảy ra. Bởi vậy, điều quan trọng là cần nhanh chóng tìm ra nguyên nhân và đưa ra các biện pháp khắc phục kịp thời để không ảnh hưởng đến dây chuyền sản xuất và chất lượng dược phẩm.
Hãy để INTECH là bạn đồng hành cùng doanh nghiệp của bạn trên con đường xây dựng nhà máy đạt tiêu chuẩn GMP.
* Tài liệu tham khảo
Phụ lục IX – Thông tư số 35/2018/TT-BYT